科研进展
【全文速递】JAMA:院外心脏骤停TTM的最佳目标温度
文章来源:IE-Learning急危重症学习平台发布时间:2021-12-30 12:23
【JAMA:院外心脏骤停TTM的最佳目标温度】
中度与轻度低温治疗对院外心脏骤停昏迷幸存者死亡率和神经系统结局的影响
CAPITAL CHILL 随机临床试验
关键点
问题:与轻度低温治疗(目标温度34°C)相比,中度低温治疗(目标温度31°C)是否能降低院外心脏骤停昏迷幸存者的死亡率或神经系统不良结局发生率?
新发现:这项随机临床试验纳入了367名院外心脏骤停成年患者,随机接受了31°C或34°C的低温治疗,180天全因死亡或神经系统预后不良率分别为48.4%和45.4%,差异不具有统计学意义。
意义:与目标温度为34°C的低温治疗相比,给予院外心脏骤停昏迷幸存者目标温度为31℃的目标温度并没有显著降低180天死亡或神经系统不良结局的发生率。
摘要重要性:院外心脏骤停昏迷幸存者发生死亡或神经功能严重损伤的概率通常很高。目前的指南推荐给予这类患者持续24小时的32°C至36°C之间的目标温度管理。然而小样本研究表明,给予更低目标体温可能会有潜在的获益。
目的:明确与轻度低温治疗(34°C)相比,中度低温治疗(31°C)是否能改善院外心脏骤停后昏迷幸存者的临床结局。
试验设计、开展背景、入组人群:这是一项在加拿大安大略省东部某三级心脏护理中心开展的单中心、双盲、随机的临床优效性试验。在2013年8月4日至2020年3月20日期间,共有389例院外心脏骤停患者入组,末次随访时间为2020年10月15日。
干预措施:将患者随机分配到目标温度为31°C(n = 193)或34°C(n = 196)的温度管理组并接受持续24小时的低温治疗。
主要结局及测量方法:主要结局是180天死亡或神经系统不良结局发生率。使用残疾评定量表评估神经系统结局,神经系统不良结局定义为评分大于5分(评分范围从0到29,29为最差结局[植物人状态])。有19个次要结局,包括180天死亡率和重症监护病房住院时长。
结果:在纳入初步分析的367名患者中(平均年龄61岁;69名女性[19%]),有366名患者(99.7%)完成了试验。在31°C组中,184名患者中有89名(48.4%)发生了主要结局,而在34°C组中,183名患者中有83名(45.4%)发生了主要结局(危险差,3.0%)[95% CI, 7.2%-13.2%];相对危险度,1.07 [95% CI,0.86-1.33];P = 0.56)。在19个次要结局中,有18个结局没有统计学意义。在接受目标温度为31℃或34℃低温治疗的患者中,180天死亡率分别为43.5%和41.0%(P = 0. 63)。31°C组患者在重症监护室的中位住院时长更久(10天 vs 7天;P = 0.004)。不良事件方面,31℃组和34℃组的深静脉血栓发生率分别为11.4%和10.9%,下腔静脉血栓发生率分别为3.8%和7.7%。
结论及实用性:与轻度低温治疗(目标温度34°C)相比,中度低温治疗(目标温度31°C)并不能显著降低院外心脏骤停昏迷幸存者180天的死亡率或神经系统不良结局发生率。然而,这项研究可能还不足以发现临床上明显的差异。
尽管近几十年来复苏医学取得了重大进步,但院外心脏骤停昏迷幸存者的预后仍然很差。存活入院的院外骤停患者死亡率仍然很高,且幸存者会有严重的神经功能障碍。
两项早期关键的试验表明,院外心脏骤停昏迷幸存者低温治疗可改善临床结局。Bernard等人开展的试验将33°C的目标核心体温与正常体温进行比较,而心脏骤停后低温(HACA)试验将目标核心温度设置在 32 °C 和 34 °C 之间与正常体温进行了比较。这两项试验都只纳入可除颤心律的院外心脏骤停昏迷幸存者。最近,非除颤心律心脏骤停后低温治疗试验(HYPERION)的结果显示,在心脏骤停昏迷幸存者中,与正常体温相比,33°C的目标低温治疗显示出良好的神经系统结局。
相反,在一项院外心脏骤停后分别以33℃与36℃为目标温度管理的试验(TTM)中,与36℃的目标温度相比,33℃的目标温度并不能降低死亡率或不良神经系统预后。因此心脏骤停后护理指南进行了修改,建议低温治疗目标温度定为32°C至36°C。
动物研究、临床观察性研究和一项小规模预试验表明,目标温度在28℃至32℃之间的中度低温治疗具有神经保护作用,并可改善心脏骤停后昏迷幸存者的临床结局。然而迄今为止,尚无评估目标温度低于32℃低温治疗效果的随机临床试验。CAPITAL CHILL试验旨在比较中度低温治疗(目标温度31°C)和轻度低温治疗(目标温度为34°C)对改善院外心脏骤停昏迷幸存者临床结局的效果。
方法
试验设计本研究是一项单中心、双盲、随机临床试验。渥太华大学心脏研究所招募了存活入院并转诊接受复苏后治疗的院外骤停患者,渥太华大学心脏研究所是一个三级心脏医疗中心,为加拿大安大略省东部120 万余人提供医疗服务。在这个区域性医疗系统中,出现院外心脏骤停的患者会在转诊医院急诊科里接受病情评估,如果骤停的原因被认为可能是心源性,则立即将患者转入心脏中心。
研究方案和统计分析计划见补充材料1。渥太华大学心脏研究所的心血管研究中心开展并协调了这项试验,并负责收集所有试验数据。独立评审委员会审查了此试验,委员会成员对于试验分组被设盲,试验的安全性由独立的数据和安全监督委员会的成员监督。该研究得到了渥太华健康科学协作研究伦理委员会的批准。由患者的代理人签署书面知情同意,如果患者神经功能恢复良好、情况允许,便由患者本人签署。
病人
我们纳入了年龄≥18岁的院外心脏骤停患者,患者在入院时仍处于昏迷状态,格拉斯哥昏迷评分≤8分。招募的患者发生心脏骤停时的初始节律不限。主要的排除标准是已知无法完成日常生活活动、继发于颅内出血的心脏骤停、具有大出血临床证据的严重凝血功能障碍、非心脏骤停导致的昏迷、与心脏骤停无关的预期寿命小于1年。
随机化
符合条件的患者在置入血管内降温导管后,会立即以1:1的比例被随机分配到目标体温31°C(中度低温)或34°C(轻度低温)的温度管理中。随机化的方法是根据心脏骤停时首次记录的节律进行分层,从4个签或6个签的乱序区块抽签。初始节律被分为可除颤节律(心室颤动或无脉室性心动过速)或不可除颤节律(停搏或无脉电活动)。患者编号和对应治疗放在密封、不透明、连续编号的信封中,以确保分配的隐蔽性,避免选择偏差。 盲法
盲法
医生、患者及家属对分组分配不知情。床旁护士是医疗团队中唯一知道分组的成员,并负责按照试验方案来管理血管内冷却导管。所有的温度监测仪均被遮挡,患者的体温单与病历分开保存。进行随访评估的医生对分组分配是被设盲的,事件评审委员会的所有成员也是如此。
目标体温管理及干预措施
我们鼓励医务人员和转运机构在自主循环恢复后尽快使用冰袋进行体温管理。患者到达心脏中心后,将血管内冷却导管(Zoll Quattro 导管)经股静脉插入下腔静脉并连接到温度管理系统(Thermogard XP 温度管理系统,Zoll Medical Corporation)进行主动冷却。该系统由一个泵组成,该泵通过安装在导管上的气囊使无菌盐水从外部装置循环,从而能够直接冷却或加热血液。在这项研究中,该设备在可行的情况下通过鼻咽探头或温度感应膀胱导管远程感应患者的温度来控制盐水的温度。所有患者均接受静脉注射肝素的抗凝治疗,以防止血管内冷却导致导管上形成血栓。所有患者在到达心脏中心后都会被建议立即行冠状动脉造影,因此会在导管室置入冷却导管;如果决定不立即行冠状动脉造影,则在重症监护室置入冷却导管。在低温治疗期间使用的镇静、镇痛和神经肌肉阻滞方案见附加材料1。
患者体温在指定的目标温度维持24小时。此后,以 0.25 °C/h 的速度主动复温,直至达到 37 °C,再维持该温度,复温加上正常温度的持续时间总计48小时。
如果认为低温治疗导致了严重不良事件,则医师可酌情升高温度3°C。如果升温之后还认为低温治疗会导致严重不良事件,则允许第二次升高温度3°C达到37°C(如果体温已经为37°C,则不做干预)。整个过程中不会暴露分组。
我们会基于多模态神经预后预测后再作出停止维持生命治疗的决定。包括一系列神经系统检查、脑电图、计算机断层扫描和脑磁共振成像。这种决定是由一个多学科团队,包括一名重症科医生、一名神经学专家和一名姑息护理专家,与病人家属共同决定。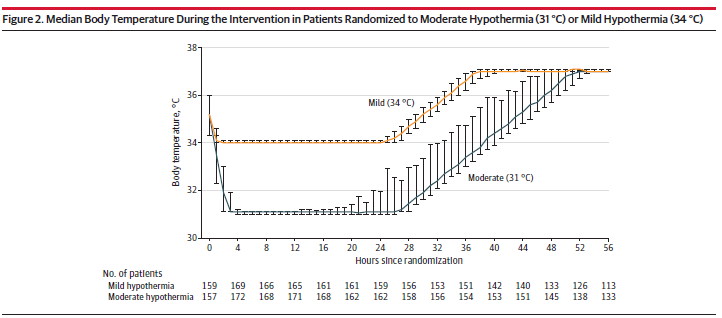
我们会基于多模态神经预后预测后再作出停止维持生命治疗的决定。包括一系列神经系统检查、脑电图、计算机断层扫描和脑磁共振成像。这种决定是由一个多学科团队,包括一名重症科医生、一名神经学专家和一名姑息护理专家,与病人家属共同决定。
研究结局
主要结局是随机分组后180天的全因死亡或不良神经系统预后。我们使用残疾评定量表 (DRS)评估神经系统预后,这是一种评估功能依赖的有8项指标的顺序量表。该功能量表用于评估患者神经功能恢复情况:DRS上的最高得分为29分(极端植物人状态)。没有残疾的人得0分。在本研究中,当DRS评分大于5时被认为神经系统预后不良。选择DRS是因为其在评估获得性脑损伤后神经功能方面的可靠性和有效性。用改良Rankin量表作为一项附加的评估,得分范围从0到6,0表示无症状,6表示死亡。改良Rankin量表中评分4至6分则是神经系统预后不良。神经系统结局由康复医学专家进行评估。
次要结局包括首次住院期间死亡、30天和180天死亡;首次住院期间及180天中风;支架血栓形成;癫痫发作;肾脏替代治疗;肺炎;心源性休克;需要抗心律失常治疗(β受体阻滞剂除外);随机分组后发生的反复难治性心脏骤停;大出血;幸存者出院比例;肌酸激酶峰值水平;经胸超声心动图测量的第3天和第3个月左室射血分数;在重症监护室内停留的时长以及住院时长。中风及支架血栓形成的主要结局指标由设盲的中央委员会判定。癫痫发作由一名被设盲的神经科专家判定。
对于神经系统结局的报告为非预设的神经系统结局。腹部超声发现的下腔静脉血栓和下肢多普勒超声发现的深静脉血栓均为严重不良事件。在研究期间,所有患者分别在第3天和第5天进行这些检查。
亚组
我们进行了亚组分析,以评估结果的稳健程度。预设了下列分组:年龄,初始节律,ST段抬高型心肌梗死,冠状动脉导管置入术和经皮冠状动脉介入术的时机。之后又做了一个性别的亚组分析。
样本量计算
根据现有研究,以 34 °C 组的主要结局预期发生率为 50% 计算样本量。需要340名患者的样本量才能发现30%的相对风险降低,其他研究也采用了这种降低方法,效能为80%,I型误差为0.05。预计随访损失最小。然而,考虑到潜在的治疗方案交叉率为3%,样本量增加到360例患者。
统计分析
主要分析包括所有随机分组到治疗组并接受治疗的患者。次要分析包括所有随机分配到治疗组的患者,无论他们是否接受治疗。另外,对所有接受治疗且没有重大违反方案行为或无失访的患者进行per-protocol分析。使用马尔科夫链蒙特卡洛方法(MCMC)和 Jeffreys 不提供信息的先验分布方法对任何缺失的结果使用多重插补。
比较随机分配到31°C或34°C目标温度患者的基线变量采用描述性统计。对于主要结局的分析,采用χ 2检验,计算相对危险度(RRs)和95% CIs,风险差异及其95% CIs。P < 0.05被认为有统计学意义。
考虑到分层随机化因素(心室性颤动或无脉性室性心动过速的初始节律),采用logistic回归分析方法评估目标温度对结局的影响。此外,我们采用logistic回归分析评估目标温度对主要结果的影响,同时考虑了先验的临床重要基线特征(如:年龄、性别、既往中风、糖尿病、肾功能和是否存在ST段抬高型心肌梗死)。
对于分类变量的次要结局,计算了RRs、风险差异及其95%可信区间。此外,使用Kaplan-Meier法估算180天的累积死亡率,并计算危险比(HRs)和95%CI。使用图形测试(即对数-负对数图)和数值测试(即交互项组×时间的测试)来评估比例风险假设。
对于连续变量的次要结局,计算平均差和95%CI。对于亚组分析,计算每个亚组的主要结局的 RR 和 95% CI,并通过使用二项分布和对数分布,在广义线性模型中对治疗组与亚组的交互作用进行检验,评估亚组差异。由于多重比较可能导致I型错误,对次要终点的分析结果应被解释为探索性的。使用 SAS 9.4 版(SAS Institute Inc)进行分析。
结果
患者特征
2013 年 8 月至 2020 年 3 月期间,对 591 名院外心脏骤停患者进行了筛选;504名符合纳入标准(图1)。其中,115 名至少符合 1 条排除标准。在研究中随机分配的 389 名患者中,31 °C 组中的 8 名患者和 34 °C 组中的 10 名患者随后被法定代理人撤回参与知情同意。31 °C 组的 1 名患者和 34 °C 组的 3 名患者因临床原因未接受干预,分别留下 184 和 183 名患者纳入初步分析。31 °C 组的一名患者出院后失访。
两组患者的基线特征相似(表1)。31℃组患者平均年龄为61.0岁,34℃组患者平均年龄为61.7岁;男性患者分别占82.6% 和 79.8% 。31 °C 组 96.7% 的患者和 34 °C 组 94.6% 的患者的心脏骤停原因是心源性(补充材料 2 中的表 1 )。31 °C 组 97.3% 的患者和 34 °C 组 96.7% 的患者接受了紧急冠状动脉造影(补充材料 2 中的表2)。2组分别有 56.3% 和 58.7% 的患者接受了经皮冠状动脉介入治疗。2组分别有 6.1% 和 10.7% 的患者需要使用主动脉内球囊反搏支持。重症监护病房中的药物和手术列在补充资料 2 的电子表格 3 中。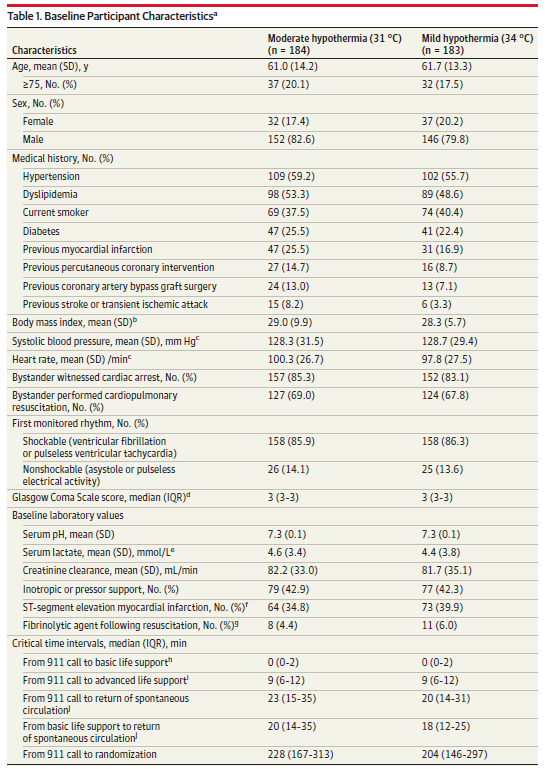 目标温度管理
目标温度管理
两组随机分组时的中位温度均为 35.2 °C。图 2描绘了以中位数和 IQR 表示的 2 组的温度曲线。31 °C 组和 34 °C 组从随机分组到达到目标温度的中位时间分别为 208 分钟和 120 分钟。
结局
主要结局
367 名患者中有 366 名可获得到 180 天的随访信息。在随机分配到 31 °C 组的 184 名患者中的 89 名(48.4%)发生了主要结局,34 °C 组的 183 名患者中的 83 名 (45.4%)发生了主要结局(风险差异,3.0% [95% CI,-7.2 % 至 13.2%];RR,1.07 [95% CI,0.86-1.33];P = .56)(表 2)。在调整基线协变量(补充材料 2 中的表 4 )以及所有亚组后,主要结局都没有显著差异。
次要结局
次要结局见表 2 。180 天时的全因死亡率在 31 °C 组中为 43.5%,在 34 °C 组中为 41.0%(风险差异,2.5% [95% CI,-7.6% 至 12.6%];RR,1.06 [95% CI,0.83-1.35];P = .63)。图3显示了随机分配到 31 °C 目标温度或34 °C 目标温度的所有患者的 180 天生存概率的 Kaplan-Meier 曲线(HR,1.09 [95% CI,0.80-1.50] ; P = .58); 图3还显示了可除颤节律患者(HR, 1.20 [95% CI, 0.82-1.73];P = 0.34)和非可除颤节律患者(HR, 0.78 [95% CI, 0.43-1.43],P = 0.40)的生存曲线。有证据支持比例风险假设(P = .49)。与 34 °C 组相比,31 °C 组在重症监护病房的中位住院时间更长(分别为 10 天和 7 天;P = .004)。另外,两组间的次要结局无显著性差异(表2)。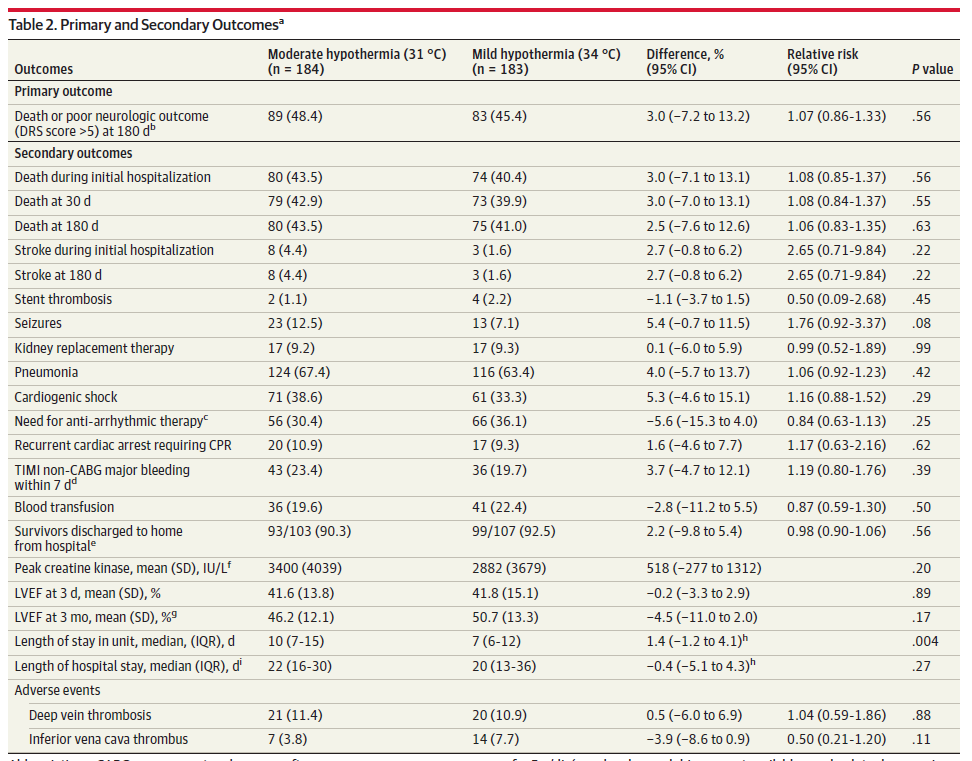 非预设结局
非预设结局
在幸存至 180 天的患者中,以 DRS 评分大于 5 分衡量的神经系统不良结局在 31 °C 组中发生率为 8.7%,在 34 °C 组中发生率为 7.4%(风险差异,1.3% [95% CI,-6.1% 至 8.6%];RR,1.17 [95% CI,0.47-2.91];P = .74)。神经系统评分的细则在补充材料 2 的表5中。同样,当不良神经系统预后被定义为 180 天改良Rankin 量表评分为 4 至 6 分时,两组之间也没有发现统计学差异(分别为 45.9% 和 43.7%;风险差异,2.2% [95% CI ,-8.0% 至12.4%];RR,1.05 [95% CI,0.84-1.32];P = 0.76)。
事后结局
31 °C 组 的61 名患者 (33.2%)和 34 °C 组的 65 名患者 (35.5%)放弃了生命维持治疗(补充材料 2 中的表6 )。神经功能障碍是放弃生命维持治疗的主要原因。两组放弃生命维持治疗的中位时间为 5 天 ( P =0 .78)。
不良事件
随机分配到 31 °C组的184名患者中有21 名 (11.4%) 发生深静脉血栓,随机分配到 34 °C 组的 183 名患者中有 20 名发生深静脉血栓 (10.9%)(风险差异,0.5% [95% CI,-6.0 % 至 6.9%];RR,1.04 [95% CI,0.59-1.86];P = .88)。31 °C 组的 184 名患者中的 7 名 (3.8%) ,34 °C 组的 183 名患者中的 14 名 (7.7%)经腹部超声记录到下腔静脉血栓(风险差异,-3.9 % [95% CI,-8.6%至0.9%];RR,0.50 [95% CI,0.21-1.20];P = .11)。
二次分析
如补充资料 2中的 e表 7 和 e表 8 所示:当对包括随机分配到研究治疗组的所有患者(无论他们是否接受了治疗)进行主要结果分析时,结果没有差异,(风险差异,2.4% [95% CI,-7.8% 至 12.6%];RR,1.05 [95% CI,0.85-1.30];P = .64);当对所有接受了分配治疗且未违反治疗方案或失访的患者进行分析结果没有差异(风险差异,4.4% [95% CI,-6.2% 至 14.7%];RR,1.10 [95% CI,0.88-1.37];P = .42)。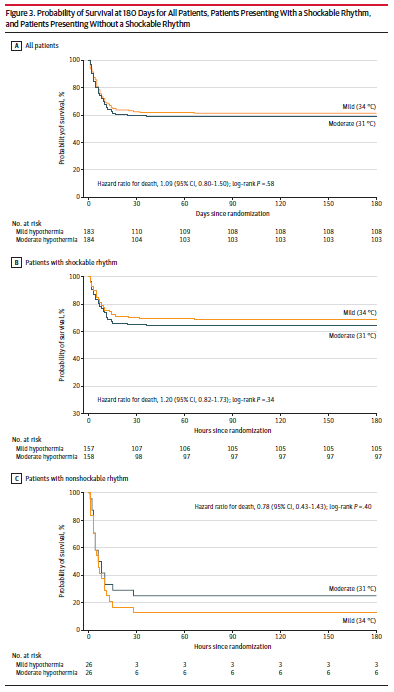
讨论
在这项针对三级心脏中心收治的院外心脏骤停昏迷幸存者进行的随机临床试验中,目标体温为31°C的中度低温治疗与体温为34°C的轻度低温治疗相比,在180天的全因死亡率和神经系统不良结局发生率方面没有显著差异。这一结果在不同的亚组之间是一致的。两组的次要结局发生率相似,只是 31 °C 组在重症监护室的住院时间比 34 °C 组更长。
评估中度低温治疗对院外心脏骤停昏迷幸存者影响的数据有限。在Lopez-de-Sa 等人的一项研究中,36名目击者院外心脏骤停的患者被随机分配到 32 °C 或 34 °C 的目标温度管理组。在初始节律为可除颤节律的患者中,与随机分配至 34 °C 的患者相比,随机分配至 32 °C 的组的患者在 6 个月时幸存且没有严重依赖他人帮助生活的患者明显更多(61.5% 对 15.4%)。随后,寻找院外心脏骤停后的最佳冷却温度 I (FROST-I) 试验以1:1:1 的比例随机分配 150 名目击者心脏骤停的昏迷幸存者,以 1:1:1 的比例进行目标温度管理,目标温度为 32 °C、33 °C 或 34 °C。这项相对较小的试验可能效力不足,并未发现不同目标温度之间 90 天的神经系统结局存在差异。
当前试验的结果不支持使用中度低温治疗来改善院外心脏骤停昏迷幸存者的神经系统预后。此外,与 34 °C 组相比,31 °C 组在心脏重症监护病房的住院时间更长可能会增加总成本。
据我们所知,这项研究是第一个评估目标温度低于32°C时低温治疗的好处的随机临床试验。所有患者均使用了血管内冷却装置,该装置可快速冷却、严格维持目标温度,并可主动控制复温。该试验评估了中度温治疗对院外心脏骤停昏迷幸存者的治疗效果,应与 TTM 试验(33 °C 与 36 °C)、FROST-I 试验(32 °C vs 33 °C vs 34 °C),以及时间差异低温治疗(TTH48)试验(24 小时 vs 48 小时,33 °C 的目标温度)的结果一起诠释,所的试验都是阴性结果。
一个重要的考虑因素可能是没有一个单一的最佳目标温度适合所有心脏骤停患者,因为低温治疗的治疗效果可能受很多临床变量的影响。许多专家主张在心脏骤停后,根据患者和骤停事件的特征、危险因素、生物标志物和对早期治疗的反应,采用个性化的方法进行针对性的体温管理。虽然本试验并非旨在解决这个问题,但在亚组分析中,未发现显著差异。
关于低温治疗的价值一直存在很多争议。院外心脏骤停后的目标低温与目标正常体温(TTM2)试验最近报道,与 37.5 °C 或更低的目标常温相比,33 °C 的目标低温治疗并未提高 180 天的生存率。目前的研究增加了目标温度管理的范围,因为没有发现将温度进一步降低到 31°C 的任何好处。
目标低温治疗是第一项被认为可以改善院外心脏骤停昏迷幸存者预后的神经保护干预措施。人们围绕最佳目标温度的不确定性进行了20多年的研究,并使得心脏骤停后治疗的多个方面得到改进。目前尚不清楚避免患者发热是否具有保护作用。
局限性
这项研究有几个局限性。首先,本研究中的大多数患者的心脏骤停继发于心源性病因。因此,研究结果可能不适用于所有病因的心脏骤停。其次,试验是在单中心进行的。尽管如此,试验方案是高度标准化的,试验是在高度专业化的心脏骤停中心进行的。第三,样本量是基于15% 的绝对风险降低估计的,可能是怀疑该研究的效力不足的原因。第四,呈现不可除颤心律的患者数量相对较少,可能需要对该亚组进一步研究。
结论
与轻度低温治疗(目标温度34°C)相比,中度低温治疗(目标温度31°C)并不能显著降低院外心脏骤停昏迷幸存者的死亡率或不良神经系统预后。然而,这项研究可能还不足以发现临床上明显的差异。
中度与轻度低温治疗对院外心脏骤停昏迷幸存者死亡率和神经系统结局的影响
CAPITAL CHILL 随机临床试验
问题:与轻度低温治疗(目标温度34°C)相比,中度低温治疗(目标温度31°C)是否能降低院外心脏骤停昏迷幸存者的死亡率或神经系统不良结局发生率?
意义:与目标温度为34°C的低温治疗相比,给予院外心脏骤停昏迷幸存者目标温度为31℃的目标温度并没有显著降低180天死亡或神经系统不良结局的发生率。

试验设计、开展背景、入组人群:这是一项在加拿大安大略省东部某三级心脏护理中心开展的单中心、双盲、随机的临床优效性试验。在2013年8月4日至2020年3月20日期间,共有389例院外心脏骤停患者入组,末次随访时间为2020年10月15日。
干预措施:将患者随机分配到目标温度为31°C(n = 193)或34°C(n = 196)的温度管理组并接受持续24小时的低温治疗。
主要结局及测量方法:主要结局是180天死亡或神经系统不良结局发生率。使用残疾评定量表评估神经系统结局,神经系统不良结局定义为评分大于5分(评分范围从0到29,29为最差结局[植物人状态])。有19个次要结局,包括180天死亡率和重症监护病房住院时长。
结果:在纳入初步分析的367名患者中(平均年龄61岁;69名女性[19%]),有366名患者(99.7%)完成了试验。在31°C组中,184名患者中有89名(48.4%)发生了主要结局,而在34°C组中,183名患者中有83名(45.4%)发生了主要结局(危险差,3.0%)[95% CI, 7.2%-13.2%];相对危险度,1.07 [95% CI,0.86-1.33];P = 0.56)。在19个次要结局中,有18个结局没有统计学意义。在接受目标温度为31℃或34℃低温治疗的患者中,180天死亡率分别为43.5%和41.0%(P = 0. 63)。31°C组患者在重症监护室的中位住院时长更久(10天 vs 7天;P = 0.004)。不良事件方面,31℃组和34℃组的深静脉血栓发生率分别为11.4%和10.9%,下腔静脉血栓发生率分别为3.8%和7.7%。
结论及实用性:与轻度低温治疗(目标温度34°C)相比,中度低温治疗(目标温度31°C)并不能显著降低院外心脏骤停昏迷幸存者180天的死亡率或神经系统不良结局发生率。然而,这项研究可能还不足以发现临床上明显的差异。
两项早期关键的试验表明,院外心脏骤停昏迷幸存者低温治疗可改善临床结局。Bernard等人开展的试验将33°C的目标核心体温与正常体温进行比较,而心脏骤停后低温(HACA)试验将目标核心温度设置在 32 °C 和 34 °C 之间与正常体温进行了比较。这两项试验都只纳入可除颤心律的院外心脏骤停昏迷幸存者。最近,非除颤心律心脏骤停后低温治疗试验(HYPERION)的结果显示,在心脏骤停昏迷幸存者中,与正常体温相比,33°C的目标低温治疗显示出良好的神经系统结局。
相反,在一项院外心脏骤停后分别以33℃与36℃为目标温度管理的试验(TTM)中,与36℃的目标温度相比,33℃的目标温度并不能降低死亡率或不良神经系统预后。因此心脏骤停后护理指南进行了修改,建议低温治疗目标温度定为32°C至36°C。
动物研究、临床观察性研究和一项小规模预试验表明,目标温度在28℃至32℃之间的中度低温治疗具有神经保护作用,并可改善心脏骤停后昏迷幸存者的临床结局。然而迄今为止,尚无评估目标温度低于32℃低温治疗效果的随机临床试验。CAPITAL CHILL试验旨在比较中度低温治疗(目标温度31°C)和轻度低温治疗(目标温度为34°C)对改善院外心脏骤停昏迷幸存者临床结局的效果。
方法
病人
我们纳入了年龄≥18岁的院外心脏骤停患者,患者在入院时仍处于昏迷状态,格拉斯哥昏迷评分≤8分。招募的患者发生心脏骤停时的初始节律不限。主要的排除标准是已知无法完成日常生活活动、继发于颅内出血的心脏骤停、具有大出血临床证据的严重凝血功能障碍、非心脏骤停导致的昏迷、与心脏骤停无关的预期寿命小于1年。
随机化
符合条件的患者在置入血管内降温导管后,会立即以1:1的比例被随机分配到目标体温31°C(中度低温)或34°C(轻度低温)的温度管理中。随机化的方法是根据心脏骤停时首次记录的节律进行分层,从4个签或6个签的乱序区块抽签。初始节律被分为可除颤节律(心室颤动或无脉室性心动过速)或不可除颤节律(停搏或无脉电活动)。患者编号和对应治疗放在密封、不透明、连续编号的信封中,以确保分配的隐蔽性,避免选择偏差。

医生、患者及家属对分组分配不知情。床旁护士是医疗团队中唯一知道分组的成员,并负责按照试验方案来管理血管内冷却导管。所有的温度监测仪均被遮挡,患者的体温单与病历分开保存。进行随访评估的医生对分组分配是被设盲的,事件评审委员会的所有成员也是如此。
目标体温管理及干预措施
我们鼓励医务人员和转运机构在自主循环恢复后尽快使用冰袋进行体温管理。患者到达心脏中心后,将血管内冷却导管(Zoll Quattro 导管)经股静脉插入下腔静脉并连接到温度管理系统(Thermogard XP 温度管理系统,Zoll Medical Corporation)进行主动冷却。该系统由一个泵组成,该泵通过安装在导管上的气囊使无菌盐水从外部装置循环,从而能够直接冷却或加热血液。在这项研究中,该设备在可行的情况下通过鼻咽探头或温度感应膀胱导管远程感应患者的温度来控制盐水的温度。所有患者均接受静脉注射肝素的抗凝治疗,以防止血管内冷却导致导管上形成血栓。所有患者在到达心脏中心后都会被建议立即行冠状动脉造影,因此会在导管室置入冷却导管;如果决定不立即行冠状动脉造影,则在重症监护室置入冷却导管。在低温治疗期间使用的镇静、镇痛和神经肌肉阻滞方案见附加材料1。
患者体温在指定的目标温度维持24小时。此后,以 0.25 °C/h 的速度主动复温,直至达到 37 °C,再维持该温度,复温加上正常温度的持续时间总计48小时。
如果认为低温治疗导致了严重不良事件,则医师可酌情升高温度3°C。如果升温之后还认为低温治疗会导致严重不良事件,则允许第二次升高温度3°C达到37°C(如果体温已经为37°C,则不做干预)。整个过程中不会暴露分组。
我们会基于多模态神经预后预测后再作出停止维持生命治疗的决定。包括一系列神经系统检查、脑电图、计算机断层扫描和脑磁共振成像。这种决定是由一个多学科团队,包括一名重症科医生、一名神经学专家和一名姑息护理专家,与病人家属共同决定。

研究结局
主要结局是随机分组后180天的全因死亡或不良神经系统预后。我们使用残疾评定量表 (DRS)评估神经系统预后,这是一种评估功能依赖的有8项指标的顺序量表。该功能量表用于评估患者神经功能恢复情况:DRS上的最高得分为29分(极端植物人状态)。没有残疾的人得0分。在本研究中,当DRS评分大于5时被认为神经系统预后不良。选择DRS是因为其在评估获得性脑损伤后神经功能方面的可靠性和有效性。用改良Rankin量表作为一项附加的评估,得分范围从0到6,0表示无症状,6表示死亡。改良Rankin量表中评分4至6分则是神经系统预后不良。神经系统结局由康复医学专家进行评估。
次要结局包括首次住院期间死亡、30天和180天死亡;首次住院期间及180天中风;支架血栓形成;癫痫发作;肾脏替代治疗;肺炎;心源性休克;需要抗心律失常治疗(β受体阻滞剂除外);随机分组后发生的反复难治性心脏骤停;大出血;幸存者出院比例;肌酸激酶峰值水平;经胸超声心动图测量的第3天和第3个月左室射血分数;在重症监护室内停留的时长以及住院时长。中风及支架血栓形成的主要结局指标由设盲的中央委员会判定。癫痫发作由一名被设盲的神经科专家判定。
对于神经系统结局的报告为非预设的神经系统结局。腹部超声发现的下腔静脉血栓和下肢多普勒超声发现的深静脉血栓均为严重不良事件。在研究期间,所有患者分别在第3天和第5天进行这些检查。
亚组
我们进行了亚组分析,以评估结果的稳健程度。预设了下列分组:年龄,初始节律,ST段抬高型心肌梗死,冠状动脉导管置入术和经皮冠状动脉介入术的时机。之后又做了一个性别的亚组分析。
样本量计算
根据现有研究,以 34 °C 组的主要结局预期发生率为 50% 计算样本量。需要340名患者的样本量才能发现30%的相对风险降低,其他研究也采用了这种降低方法,效能为80%,I型误差为0.05。预计随访损失最小。然而,考虑到潜在的治疗方案交叉率为3%,样本量增加到360例患者。
统计分析
主要分析包括所有随机分组到治疗组并接受治疗的患者。次要分析包括所有随机分配到治疗组的患者,无论他们是否接受治疗。另外,对所有接受治疗且没有重大违反方案行为或无失访的患者进行per-protocol分析。使用马尔科夫链蒙特卡洛方法(MCMC)和 Jeffreys 不提供信息的先验分布方法对任何缺失的结果使用多重插补。
比较随机分配到31°C或34°C目标温度患者的基线变量采用描述性统计。对于主要结局的分析,采用χ 2检验,计算相对危险度(RRs)和95% CIs,风险差异及其95% CIs。P < 0.05被认为有统计学意义。
考虑到分层随机化因素(心室性颤动或无脉性室性心动过速的初始节律),采用logistic回归分析方法评估目标温度对结局的影响。此外,我们采用logistic回归分析评估目标温度对主要结果的影响,同时考虑了先验的临床重要基线特征(如:年龄、性别、既往中风、糖尿病、肾功能和是否存在ST段抬高型心肌梗死)。
对于分类变量的次要结局,计算了RRs、风险差异及其95%可信区间。此外,使用Kaplan-Meier法估算180天的累积死亡率,并计算危险比(HRs)和95%CI。使用图形测试(即对数-负对数图)和数值测试(即交互项组×时间的测试)来评估比例风险假设。
对于连续变量的次要结局,计算平均差和95%CI。对于亚组分析,计算每个亚组的主要结局的 RR 和 95% CI,并通过使用二项分布和对数分布,在广义线性模型中对治疗组与亚组的交互作用进行检验,评估亚组差异。由于多重比较可能导致I型错误,对次要终点的分析结果应被解释为探索性的。使用 SAS 9.4 版(SAS Institute Inc)进行分析。
患者特征
两组患者的基线特征相似(表1)。31℃组患者平均年龄为61.0岁,34℃组患者平均年龄为61.7岁;男性患者分别占82.6% 和 79.8% 。31 °C 组 96.7% 的患者和 34 °C 组 94.6% 的患者的心脏骤停原因是心源性(补充材料 2 中的表 1 )。31 °C 组 97.3% 的患者和 34 °C 组 96.7% 的患者接受了紧急冠状动脉造影(补充材料 2 中的表2)。2组分别有 56.3% 和 58.7% 的患者接受了经皮冠状动脉介入治疗。2组分别有 6.1% 和 10.7% 的患者需要使用主动脉内球囊反搏支持。重症监护病房中的药物和手术列在补充资料 2 的电子表格 3 中。

两组随机分组时的中位温度均为 35.2 °C。图 2描绘了以中位数和 IQR 表示的 2 组的温度曲线。31 °C 组和 34 °C 组从随机分组到达到目标温度的中位时间分别为 208 分钟和 120 分钟。
结局
主要结局
367 名患者中有 366 名可获得到 180 天的随访信息。在随机分配到 31 °C 组的 184 名患者中的 89 名(48.4%)发生了主要结局,34 °C 组的 183 名患者中的 83 名 (45.4%)发生了主要结局(风险差异,3.0% [95% CI,-7.2 % 至 13.2%];RR,1.07 [95% CI,0.86-1.33];P = .56)(表 2)。在调整基线协变量(补充材料 2 中的表 4 )以及所有亚组后,主要结局都没有显著差异。
次要结局
次要结局见表 2 。180 天时的全因死亡率在 31 °C 组中为 43.5%,在 34 °C 组中为 41.0%(风险差异,2.5% [95% CI,-7.6% 至 12.6%];RR,1.06 [95% CI,0.83-1.35];P = .63)。图3显示了随机分配到 31 °C 目标温度或34 °C 目标温度的所有患者的 180 天生存概率的 Kaplan-Meier 曲线(HR,1.09 [95% CI,0.80-1.50] ; P = .58); 图3还显示了可除颤节律患者(HR, 1.20 [95% CI, 0.82-1.73];P = 0.34)和非可除颤节律患者(HR, 0.78 [95% CI, 0.43-1.43],P = 0.40)的生存曲线。有证据支持比例风险假设(P = .49)。与 34 °C 组相比,31 °C 组在重症监护病房的中位住院时间更长(分别为 10 天和 7 天;P = .004)。另外,两组间的次要结局无显著性差异(表2)。

在幸存至 180 天的患者中,以 DRS 评分大于 5 分衡量的神经系统不良结局在 31 °C 组中发生率为 8.7%,在 34 °C 组中发生率为 7.4%(风险差异,1.3% [95% CI,-6.1% 至 8.6%];RR,1.17 [95% CI,0.47-2.91];P = .74)。神经系统评分的细则在补充材料 2 的表5中。同样,当不良神经系统预后被定义为 180 天改良Rankin 量表评分为 4 至 6 分时,两组之间也没有发现统计学差异(分别为 45.9% 和 43.7%;风险差异,2.2% [95% CI ,-8.0% 至12.4%];RR,1.05 [95% CI,0.84-1.32];P = 0.76)。
事后结局
31 °C 组 的61 名患者 (33.2%)和 34 °C 组的 65 名患者 (35.5%)放弃了生命维持治疗(补充材料 2 中的表6 )。神经功能障碍是放弃生命维持治疗的主要原因。两组放弃生命维持治疗的中位时间为 5 天 ( P =0 .78)。
不良事件
随机分配到 31 °C组的184名患者中有21 名 (11.4%) 发生深静脉血栓,随机分配到 34 °C 组的 183 名患者中有 20 名发生深静脉血栓 (10.9%)(风险差异,0.5% [95% CI,-6.0 % 至 6.9%];RR,1.04 [95% CI,0.59-1.86];P = .88)。31 °C 组的 184 名患者中的 7 名 (3.8%) ,34 °C 组的 183 名患者中的 14 名 (7.7%)经腹部超声记录到下腔静脉血栓(风险差异,-3.9 % [95% CI,-8.6%至0.9%];RR,0.50 [95% CI,0.21-1.20];P = .11)。
二次分析
如补充资料 2中的 e表 7 和 e表 8 所示:当对包括随机分配到研究治疗组的所有患者(无论他们是否接受了治疗)进行主要结果分析时,结果没有差异,(风险差异,2.4% [95% CI,-7.8% 至 12.6%];RR,1.05 [95% CI,0.85-1.30];P = .64);当对所有接受了分配治疗且未违反治疗方案或失访的患者进行分析结果没有差异(风险差异,4.4% [95% CI,-6.2% 至 14.7%];RR,1.10 [95% CI,0.88-1.37];P = .42)。

在这项针对三级心脏中心收治的院外心脏骤停昏迷幸存者进行的随机临床试验中,目标体温为31°C的中度低温治疗与体温为34°C的轻度低温治疗相比,在180天的全因死亡率和神经系统不良结局发生率方面没有显著差异。这一结果在不同的亚组之间是一致的。两组的次要结局发生率相似,只是 31 °C 组在重症监护室的住院时间比 34 °C 组更长。
当前试验的结果不支持使用中度低温治疗来改善院外心脏骤停昏迷幸存者的神经系统预后。此外,与 34 °C 组相比,31 °C 组在心脏重症监护病房的住院时间更长可能会增加总成本。
据我们所知,这项研究是第一个评估目标温度低于32°C时低温治疗的好处的随机临床试验。所有患者均使用了血管内冷却装置,该装置可快速冷却、严格维持目标温度,并可主动控制复温。该试验评估了中度温治疗对院外心脏骤停昏迷幸存者的治疗效果,应与 TTM 试验(33 °C 与 36 °C)、FROST-I 试验(32 °C vs 33 °C vs 34 °C),以及时间差异低温治疗(TTH48)试验(24 小时 vs 48 小时,33 °C 的目标温度)的结果一起诠释,所的试验都是阴性结果。
一个重要的考虑因素可能是没有一个单一的最佳目标温度适合所有心脏骤停患者,因为低温治疗的治疗效果可能受很多临床变量的影响。许多专家主张在心脏骤停后,根据患者和骤停事件的特征、危险因素、生物标志物和对早期治疗的反应,采用个性化的方法进行针对性的体温管理。虽然本试验并非旨在解决这个问题,但在亚组分析中,未发现显著差异。
关于低温治疗的价值一直存在很多争议。院外心脏骤停后的目标低温与目标正常体温(TTM2)试验最近报道,与 37.5 °C 或更低的目标常温相比,33 °C 的目标低温治疗并未提高 180 天的生存率。目前的研究增加了目标温度管理的范围,因为没有发现将温度进一步降低到 31°C 的任何好处。
目标低温治疗是第一项被认为可以改善院外心脏骤停昏迷幸存者预后的神经保护干预措施。人们围绕最佳目标温度的不确定性进行了20多年的研究,并使得心脏骤停后治疗的多个方面得到改进。目前尚不清楚避免患者发热是否具有保护作用。
局限性
这项研究有几个局限性。首先,本研究中的大多数患者的心脏骤停继发于心源性病因。因此,研究结果可能不适用于所有病因的心脏骤停。其次,试验是在单中心进行的。尽管如此,试验方案是高度标准化的,试验是在高度专业化的心脏骤停中心进行的。第三,样本量是基于15% 的绝对风险降低估计的,可能是怀疑该研究的效力不足的原因。第四,呈现不可除颤心律的患者数量相对较少,可能需要对该亚组进一步研究。
与轻度低温治疗(目标温度34°C)相比,中度低温治疗(目标温度31°C)并不能显著降低院外心脏骤停昏迷幸存者的死亡率或不良神经系统预后。然而,这项研究可能还不足以发现临床上明显的差异。
